
Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
1. Bilangan oksidasi unsur bebas adalah 0 (nol) 2. Bilangan oksidasi ion monoatomik sama dengan muatannya. 3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) 4. Bilangan oksidasi atom-atom pembentuk ion poliatomik sama dengan muatannya. 5.

Penyetaraan reaksi redoks MnO4 dan SO3 2 dalam suasana asam dengan metode bilangan oksidasi
Tetapkan bilangan oksidasi -2 pada oksigen (tanpa perkecualian). Dalam hampir semua kasus, atom oksigen memiliki bilangan oksidasi -2. Ada beberapa perkecualian dalam peraturan ini: Saat oksigen berada dalam bentuk unsur (O 2 ), bilangan oksidasinya adalah 0, karena ini adalah peraturan untuk semua atom unsur.
Contoh Soal Penyetaraan Reaksi Redoks Metode Bilangan Oksidasi Suasana Asam Riset
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.

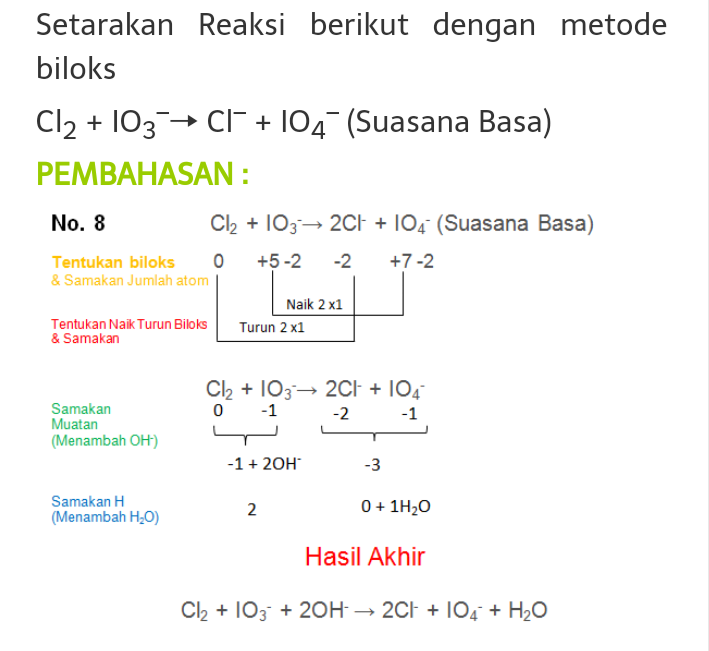
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
Bilangan oksidasi adalah suatu bilangan yang menunjukkan ukuran kemampuan suatu atom untuk melepas atau menangkap elektron dalam pembentukan suatu senyawa. Nilai bilangan oksidasi menunjukkan banyaknya elektron yang dilepas atau ditangkap, sehingga bilangan oksidasi dapat bertanda positif maupun negatif.. Ada dua metode penyetaraan reaksi.

Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
Contoh 1 Metode Setengah Reaksi dalam Suasana Asam. Perhatikan contoh berikut ini (dalam suasana asam) 1) Memisahkan reaksi redoks menjadi reaksi reduksi dan reaksi oksidasi. Bilangan oksidasi Cr pada Cr 2 O 72- = +6 sedangkan bilangan oksidasi pada Cr 3+ = +3, berarti terjadi reaksi reduksi.

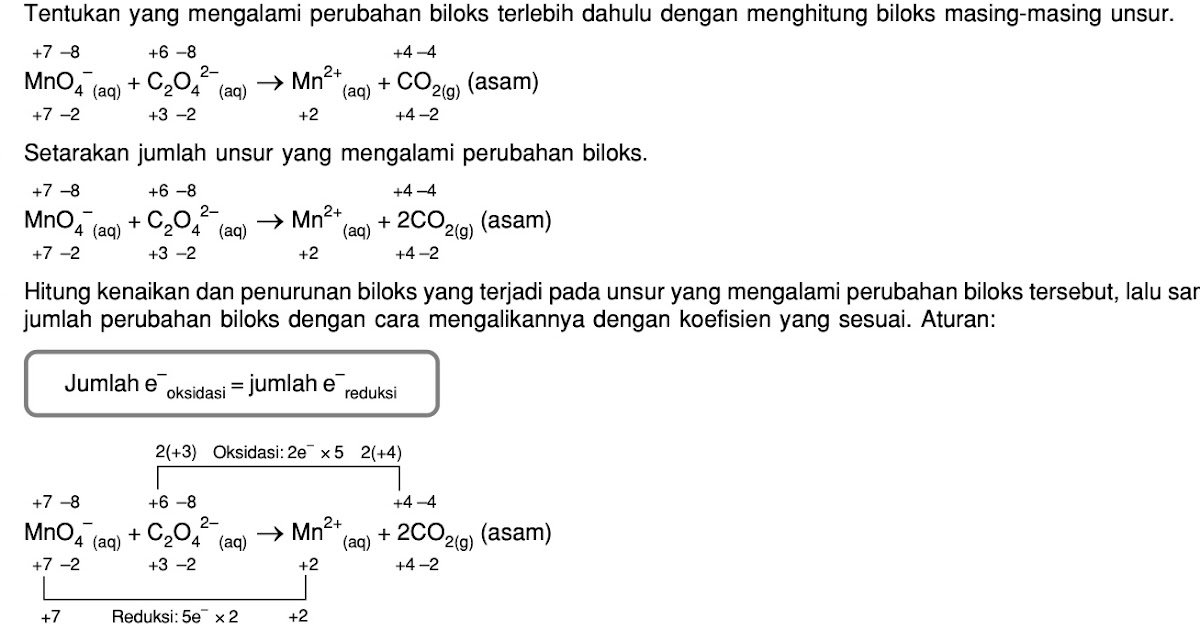
Penyetaraan reaksi redoks MnO4− + C2O42− → Mn2+ + CO2 dg metode bilangan oksidasi dalam suasana
Dalam kimia, bilangan oksidasi, biloks, atau keadaan oksidasi, adalah muatan hipotesis sebuah atom jika semua ikatannya dengan atom yang berbeda sepenuhnya ionik.. Pada tahun 1990, IUPAC menggunakan metode postulatori (berbasis aturan) untuk menentukan bilangan oksidasi.

Setarakanlah reaksi redoks berikut dengan menggunakan metode bilangan oksidasi! YouTube
Penyetaraan: MnO + PbO2 → MnO4- + Pb2+ (suasana asam) menggunakan metode perubahan bilangan oksidasi (PBO).#PenyetaraanReaksi Redoks#MetodePBO#PersamaanReaks.
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi My XXX Hot Girl
Penyetaraan MnO4-+ C2O42- → MnO2 + CO2 (suasana basa)menggunakan metode perubahan bilangan oksidasi (PBO).Hasil reaksi setara:2MnO4- + 3C2O42- + 4H2O → 2MnO2.

Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

setarakan reaksi redoks berikut dengan metode bilangan oksidasi mno+pbo2+hno3>hmno4+pb(no3)2+h2o
Metode bilangan oksidasi berdasarkan prinsip bahwa jumlah pertambahan bilangan oksidasi dari reduktor sama dengan jumlah penurunan bilangan oksidasi dari oksidator. Penyetaraan ini memiliki dua tipe reaksi yakni reaksi molekul dan reaksi ion. 1) Penyetaraan Persamaan Reaksi Redoks Metode Perubahan Biloks (Molekul).

PENYETARAAN REAKSI REDOKS DENGAN METODE BILANGAN OKSIDASI YouTube
Cara II Metode Setengah Reaksi. Bagi reaksi menjadi 2, satu reduksi dan satu oksidasi; Samakan jumlah unsur yang berubah biloks. Samakan jumlah atom O dengan menambahkan H 2 O di yang kurang O sebanyak kekurangannya (Suasana asam), atau menambahkan H 2 O di yang lebih O sebanyak kelebihannya (suasana basa).; Samakan jumlah atom H dengan menambahkan H + (suasana asam) atau OH - (suasana basa).
setarakan menggunakan metode bilangan oksidasi Mn...
Metode bilangan oksidasi menjadi penanda penting yang memungkinkan kita untuk melacak perubahan muatan elektron saat unsur tersebut bergabung dan membentuk senyawa baru. Nah, bayangkan senyawa sebagai sebuah pesta, dan setiap unsur adalah tamu undangan yang berbeda. Jika kita ingin memahami dinamika di sekitar kita, berguna untuk mengetahui.
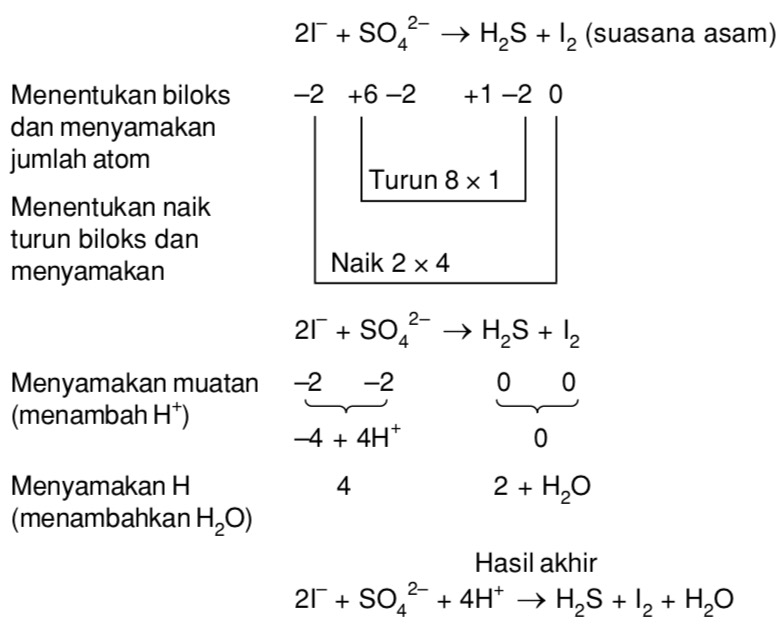
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
Metode Bilangan Oksidasi. Elo cermati mana aja unsur yang mengalami perubahan biloks, hitung biloks setiap elemen, lalu hitung kenaikan atau penurunan biloks per unsurnya. Beri label mana aja unsur yang merupakan reduktor dan oksidator. Samakan jumlah kenaikan dan penurunan biloks. Kalau udah sama, udah elo nggak usah apa-apain lagi.

Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
Metode bilangan oksidasi adalah cara yang lumayan simpel untuk menentukan bilangan oksidasi tiap unsur dalam suatu senyawa atau zat. Bilangan oksidasi sendiri adalah 'nomor' atau angka yang menunjukkan apakah suatu unsur kehilangan elektron (oksidasi) atau menerimanya (reduksi). Dengan mengetahui bilangan oksidasi, kita bisa setarakan.

Cara Cepat Menyetarakan Reaksi Redoks (Metode Bilangan Oksidasi) YouTube
Aturan Penentuan Bilangan Oksidasi. Setelah memahami pengertian, Sobat Zenius juga harus tahu aturan biloks. Aturan yang menentukan bilangan oksidasi yang benar adalah: Unsur Bebas → Biloks = 0. Contoh: Na, K, Cl 2, M 2, dan O 2. Logam yang Berikatan dengan Unsur Lain → Biloks = Positif. Contoh: Gol I: Na, K, Rb → biloks = +1

Cara mudah menentukan bilangan oksidasi dalam senyawa kimia YouTube
Bilangan oksidasi Fe pada FeO adalah +2 sedangkan pada Fe 2 O 3 adalah +3, karena terjadi penambahan bilangan oksidasi dari +2 menjadi +3 maka reaksi tersebut merupakan reaksi oksidasi. FeO bertindak sebagai reduktor, dan hasil oksidasinya adalah Fe 2 O 3. Baca juga: Mengenal Ikatan Hidrogen.